从动物实验到临床希望: 干细胞外泌体干预缺氧性肺动脉高压
发布日期:2025-08-16 01:01 点击次数:77
缺氧性肺动脉高压(Hypoxic Pulmonary Hypertension, HPH)是一种由长期低氧环境(如慢性阻塞性肺疾病、慢性高原病等)引发的进行性肺血管疾病。其主要特征是肺动脉压力持续升高,最终可能因右心衰竭而导致患者死亡。该病的病理进程涉及肺血管重构,包括肺动脉平滑肌细胞异常增殖、血管壁增厚及纤维化,这会显著增加右心室后负荷。尽管现有的扩血管药物能够在一定程度上缓解症状,但对于疾病进程的逆转作用相对有限,部分重症患者甚至只能通过肺移植来维持生命。
干细胞外泌体:靶向调控病理机制的新策略
南京医科大学附属苏州医院与苏州大学的联合团队在《Scientific Reports》(2025 年 7 月)上发表了一项重要研究,首次系统地揭示了骨髓间充质干细胞外泌体(MSC-exo)通过精准调控关键信号通路,有效逆转 HPH 病理进程的分子机制,为 HPH 的治疗带来了新的希望。

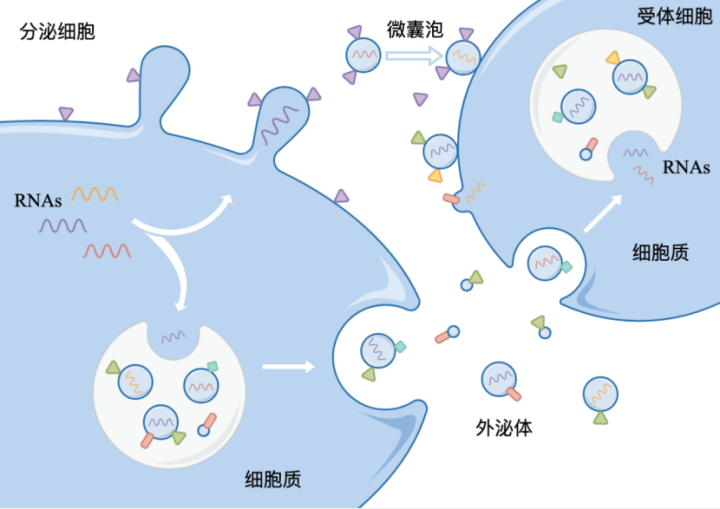
干细胞外泌体:细胞间通信的 “纳米信使”
外泌体是细胞分泌的纳米级细胞外囊泡(直径 30-150 nm),内含蛋白质、脂质、mRNA 及非编码 RNA 等多种生物活性分子,可通过旁分泌或内分泌方式精准调控靶细胞功能。相较于传统的干细胞移植,外泌体具有低免疫原性、无致瘤风险、易于保存等显著优势,被视为 “无细胞治疗” 的典型代表,为细胞治疗领域开辟了 2.0 时代的新方向。
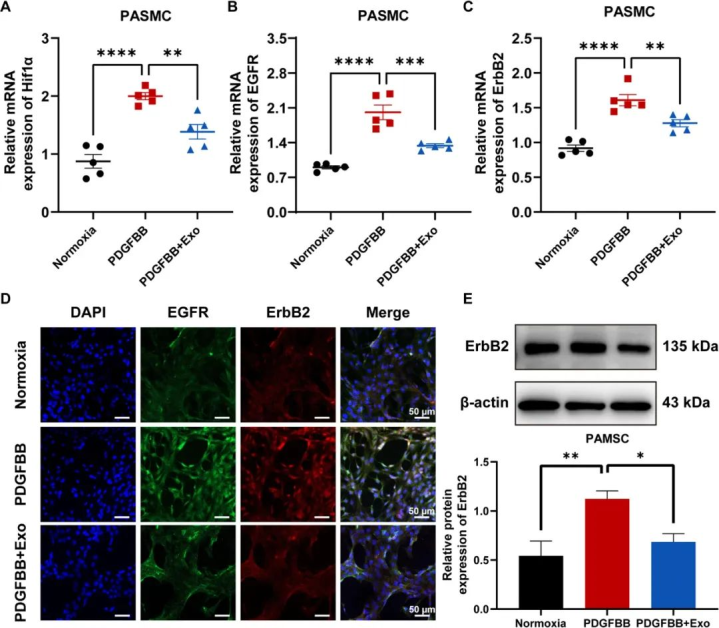
核心发现:阻断 EGFR/ErbB2 异二聚体信号通路
研究通过体外细胞实验与体内动物模型(HPH 大鼠)证实,HPH 的关键病理驱动因素是肺动脉平滑肌细胞(PASMC)异常增殖与迁移,而这一过程高度依赖表皮生长因子受体(EGFR)与 ErbB2 受体形成的异源二聚体(EGFR/ErbB2)信号通路激活。MSC-exo 能够通过递送特定的 miRNA(如 miR-145、miR-126 等),直接抑制 EGFR 与 ErbB2 的磷酸化及下游 PI3K/AKT、MAPK 信号传导,从而从源头阻断血管重构的分子开关。
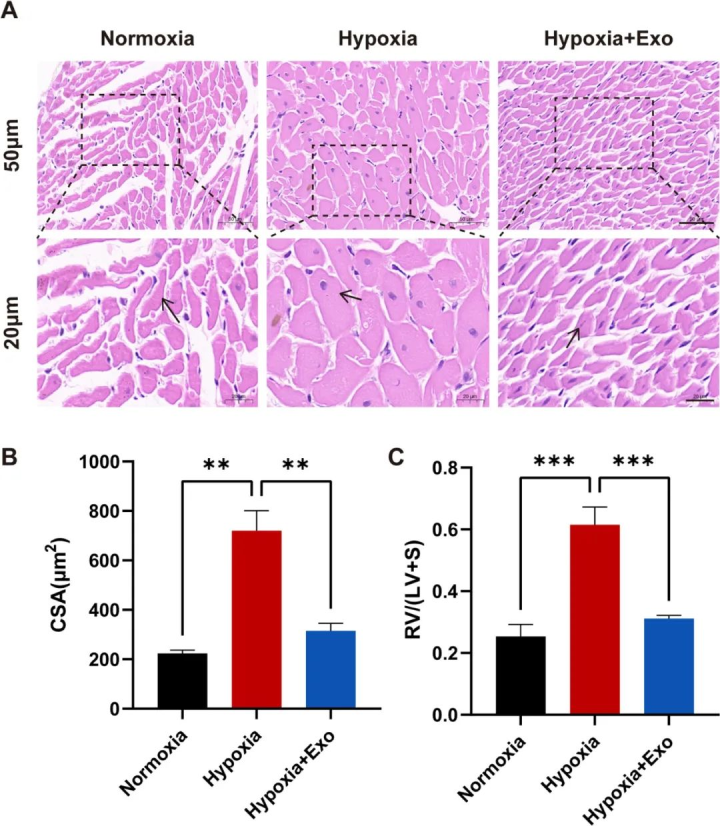
动物实验验证:多维度病理指标改善
在 HPH 大鼠模型中,通过静脉注射 MSC-exo(每周 2 次,持续 4 周)后,研究人员观察到了以下显著效果:
血流动力学改善 :平均肺动脉压(mPAP)降低 32.7%,右心室收缩压(RVSP)下降 28.4%。
结构逆转 :肺小动脉中膜厚度占比(MT%)减少 41.2%,血管周围纤维化面积降低 38.6%。
分子标志物调控 :肺组织中 HIF-1α(低氧诱导因子 - 1α)、EGFR、ErbB2 及下游 p-AKT 蛋白表达显著下调(p
这些研究结果表明,MSC-exo 不仅能够改善 HPH 的临床症状,更能从分子水平实现 “精准打击”,为疾病的治疗提供了明确的靶点。
小结
该项研究首次明确了 MSC-exo 通过抑制 EGFR/ErbB2 异二聚体信号治疗 HPH 的分子机制,为外泌体疗法在难治性心肺疾病中的应用奠定了坚实的实验基础。未来,基于该靶点开发特异性外泌体制剂或小分子抑制剂,有望突破传统治疗的局限性。不过,需要注意的是,当前的研究成果仍局限于动物模型阶段,后续还需要通过多中心临床试验来进一步验证其安全性和有效性。但不可否认的是,干细胞外泌体作为 “天然药物载体”,正逐渐成为肺动脉高压精准医疗领域最具潜力的研究方向之一。